Le malattie cardiovascolari sono la prima causa di morte nel mondo. Nel nostro paese 240.000 individui all’anno decedono per ischemie, infarti cardiaci, malattie del cuore e cerebrovascolari.
“Il 50 % del numero totale degli individui che muoiono per infarto cardiaco in modo improvviso e inaspettato hanno il colesterolo totale nella norma.”
Ci si pone dunque inevitabilmente la domanda: “Ma il livello di colesterolo è veramente attendibile come fattore di rischio se si muore di infarto pur avendo il colesterolo nella norma?”. La risposta è: no, assolutamente no. Prima di descrivere quali sono i fattori di rischio cardiovascolari veramente attendibili è utile conoscere meglio l’imputato innocente.
Il Colesterolo che cos’è e a cosa serve ?
E’ importante precisare subito che il colesterolo è un alcol e non un grasso, si comporta dunque molto diversamente da un grasso. Non essendo solubile nell’acqua, il colesterolo circola nel sangue esclusivamente se abbinato a delle molecole che lo trasportano. Queste molecole capaci di trasportare i diversi tipi di colesterolo vengono chiamate lipoproteine.
Il colesterolo che non ha origine alimentare ma che viene prodotto dal nostro corpo, costituisce il 75% del colesterolo totale, solo il 25% ha origine alimentare. Sappiamo anche che la produzione di colesterolo aumenta in caso di alimentazione troppo ricca in zuccheri e carboidrati, ma non in caso di consumo di grassi né di uova. Cade, a questo punto, l’associazione tra alimentazione ricca in grassi e l’aumento del colesterolo.
Il colesterolo periferico non riesce ad attraversare la barriera emato-encefalica per arrivare al cervello. Sono le cellule nervose del cervello, denominate oligodendrociti, che producono il colesterolo necessario al cervello.
Il nostro organismo usa il colesterolo per:
- sintetizzare la vitamina D che interviene nel metabolismo renale e intestinale del calcio e del fosforo oltre che nel metabolismo delle ossa. La vitamina D ha un importante ruolo immunitario e protegge dalle infezioni virali. Una fonte particolarmente ricca di Vitamina D, è l’olio di fegato di merluzzo.
- sintetizzare gli ormoni steroidi, i principali sono: il cortisolo, il progesterone, gli estrogeni, il testosterone, il pregnenolone, il DHEA, l’androstenedione e l’aldosterone. Durante il processo di invecchiamento vengono formati sempre meno ormoni ed è dunque normale che il colesterolo, dal quale vengono sintetizzati, si accumuli provocando così nel periodo di andropausa e di menopausa un innalzamento fisiologico del colesterolo totale. E’ anche evidente che in caso di un metabolismo lento, che si riscontra spesso in un ipotiroidismo funzionale, viene trasformato meno colesterolo e quindi si assiste ad un aumento di colesterolo se il metabolismo della tiroide è lento.
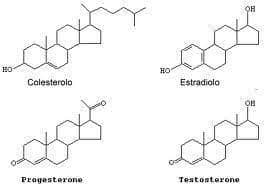
Fig. 2. La struttura base del colesterolo, con la sua tipica struttura a quattro anelli, che forma la struttura centrale dei diversi ormoni steroidi, è facilmente riconoscibile al loro interno.
- formare la guaina mielinica dei nervi che ha funzione di isolante per il nervo e permette di accelerare la trasmissione degli impulsi nervosi. E’ proprio questa guaina che viene attaccata dai processi autoimmuni caratteristici della sclerosi multipla.
- formare la bile e gli acidi biliari. Infatti, il colesterolo in eccesso viene eliminato dall’organismo attraverso la formazione di bile da parte del fegato.
- la divisione cellulare che porta alla riproduzione delle cellule.
- lo sviluppo embrionale. Infatti, esistono malformazioni del feto dovute ad un deficit di formazione del colesterolo.
- partecipare alla formazione di tutte le nostre membrane cellulari. La natura, per contenere lo stato acquoso del citoplasma che forma l’interno delle nostre cellule, l’ha circondato con una membrana di grasso formato da lipidi e colesterolo, Diverse sostanze hanno la necessità di attraversare questa membrana, sia verso l’interno sia verso l’esterno, esistono per questo delle zone specifiche denominate “Zattere Lipidiche” che contengono canali di comunicazione altamente specializzati. Queste zone sono meno rigide, per contenere i detti canali, perciò in queste aree della membrana la natura ha previsto un aumento di colesterolo. Il colesterolo, così, è un elemento importante per la struttura e per l’elasticità delle nostre membrane cellulari.
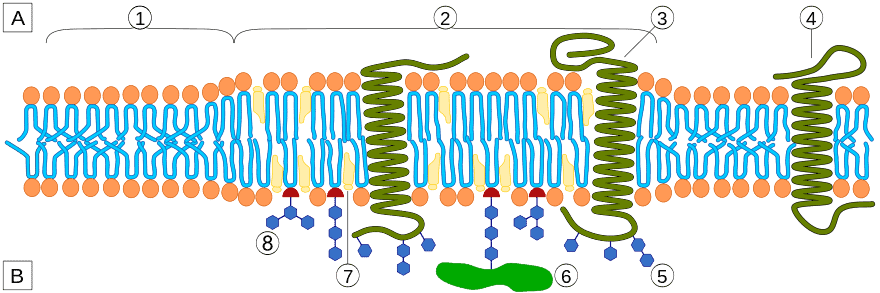
Fig. 3. La Zattera Lipidica: 1. Zona meno elastica della membrana cellulare che non contiene canali di comunicazione ed è priva di colesterolo. 2. Zona più elastica della membrana cellulare che contiene la Zattera Lipidica ricca di canali di comunicazione e ad altra concentrazione di colesterolo. 3. Canali di proteine transmembrana. 4. Proteina transmembrana esterna alla Zattera Lipidica. 5. Proteina glicosilata, cioè alla quale viene aggiunto una frazione glucidica. 6. Proteina alla quale estremità si può ancorare un struttura a base di inositolo che le permette di avere un polo idrofilo all’esterno della membrana. 7. Colesterolo, la quale presenza delimita la zona di Zattera Lipidica. 8. Glicolipidi, i quali hanno funzione di riconoscere sostanze chimiche specifiche provenienti dall’esterno aiutando a mantenere l’equilibrio all’interno della cellula. (credit: it.wikipedia.org)
- formare la bile e gli acidi biliari. Infatti, il colesterolo in eccesso viene eliminato dall’organismo attraverso la formazione di bile da parte del fegato.
- la divisione cellulare che porta alla riproduzione delle cellule.
- Infine, il colesterolo partecipa allo sviluppo embrionale.
Quali sono i diversi “tipi” di Colesterolo ?
Quando in medicina si parla di “colesterolo totale”, non si intende il colesterolo come sostanza chimica o molecola, in realtà ci si riferisce in modo poco chiaro alle lipoproteine plasmatiche che trasportano il colesterolo e che circolano nel sangue durante il digiuno.
Queste lipoproteine daranno il nome a “diversi” tipi di colesterolo, o meglio, a diverse molecole che trasportano il colesterolo e che vengono classificate secondo le loro densità.
Le principali forme di colesterolo, o meglio di lipoproteine, sono:
– Il Colesterolo Totale: è la somma totale delle lipoproteine HDL e LDL che trasportano il colesterolo.
– I Chilomicroni: Sono le lipoproteine meno dense ma di maggior diametro che trasportano soprattutto i trigliceridi e una minore quantità di colesterolo assorbiti a livello dell’intestino tenue verso i vasi linfatici e infine nel circolo sanguigno. Sono presenti soprattutto immediatamente dopo i pasti. Il tasso di chilomicroni influisce poco sulla colesterolemia totale a digiuno
– Il Colesterolo HDL (High Density Lipoprotein) o Lipoproteina ad alta densità. E’ stato chiamato “Colesterolo Buono” perché le sue particelle sono capaci di legarsi alle pareti cellulari e di inglobare il colesterolo in esubero, come anche di rimuovere il colesterolo presente in eccesso nel plasma sanguigno Le HDL, cariche di colesterolo, raggiungono le cellule del fegato dove scaricano quello in eccesso che potrà o essere riutilizzato dal fegato o eliminato attraverso la bile. La Lipoproteina A-1(Apo A-1) è la componente proteica principale delle lipoproteine HDL.
– Il Colesterolo LDL (Low Density Lipoprotein) o Lipoproteina a bassa densità. E’ stato chiamato “Colesterolo Cattivo” in quanto diverso dal “Colesterolo Buono”. Ma, in realtà non è né buono né cattivo, svolge un ruolo importantissimo per l’intero organismo. Le LDL, come le HDL, hanno il compito di trasportare il colesterolo nel sangue, ma invece di trasportarlo verso il fegato per essere eliminato, lo trasportano dal fegato verso i tessuti e lo cedono a questi perché sia metabolizzato.
La Lipoproteina B-100(Apo B) è la componente proteica principale delle lipoproteine LDL.
La lipoproteina A o Lp(a) è costituita da una particella di LDL alla quale si è attaccata una lunga catena di polipeptidi grazie ad un ponte disulfurico. La sua esistenza è regolata e determinata dal gene LPA. La Lp(a) può avere un ruolo nella trombogenesi e nell’aterogenesi. Nel nostro approccio clinico misuriamo il suo tasso nel sangue e la consideriamo come un fattore di rischio secondario. E’ interessante sapere che il suo livello non si modifica con la terapia a base di statine, né con un intervento dietetico classico. Spesso è considerato come un fattore di colesterolo di tipo genetico, personalmente ho riscontrato che il suo tasso scende con l’integrazione della Vitamina B3 (Niacina) che stimola la produzione di Ossido Nitrico da parte dell’endotelio vascolare.
Questo processo è reso possibile dalla presenza di specifici recettori (LDL-receptor) posti sulla superficie esterna della membrana cellulare, i quali sono in grado di riconoscere le LDL e di legarle. Il complesso così formato viene assorbito all’interno della cellula dove specifici enzimi lisosomiali digeriscono il guscio delle LDL liberando così il colesterolo all’interno della cellula. Dopo la degradazione del complesso, il recettore LDL torna sulla superficie della membrana cellulare.
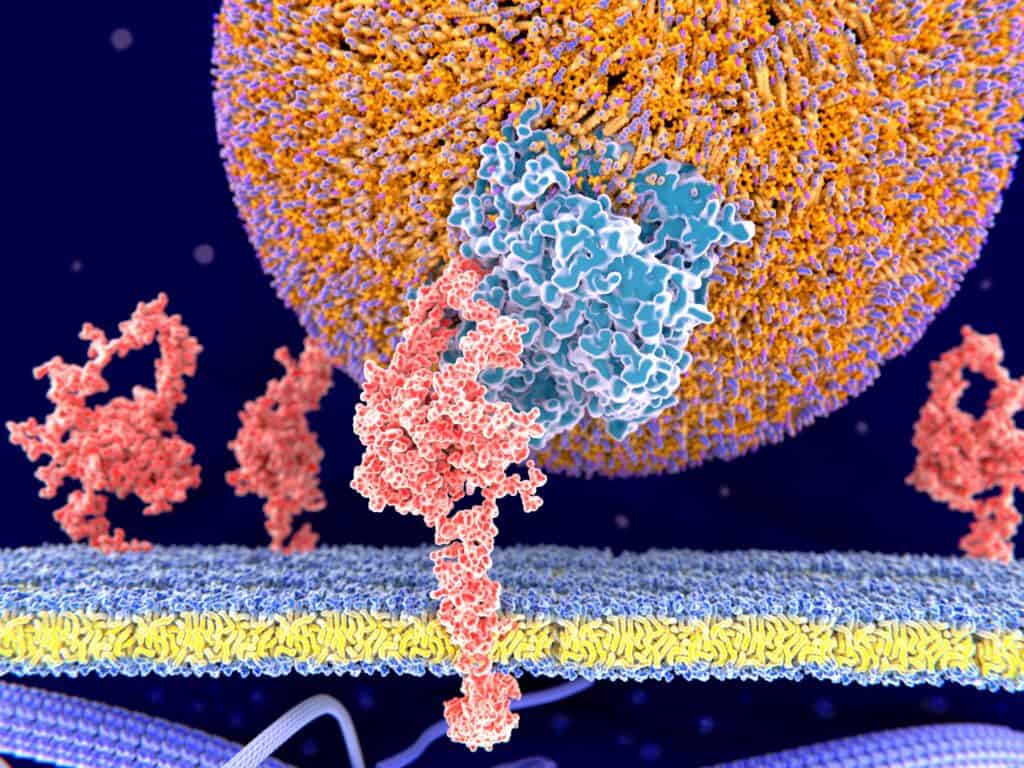
Fig. 4. Membrana cellulare (giallo) con alla sua superficie un recettore LDL (bianco-rosa) che ha legato un lipoproteina B formato dal suo guscio (sfera viola-arancione) che contiene diverse molecole di colesterolo e di trigliceridi (arancione).
“Davanti al ruolo fondamentale che ricopre il Colesterolo LDL, è impensabile continuare a sostenere che sia “cattivo” e che da solo costituisca un fattore di rischio credibile sul quale ci si possa appoggiare per una decisione di natura terapeutica. A tale scopo esistono oramai altri parametri di laboratorio più precisi ed affidabili.”
Alcuni tessuti ai fini di sintetizzare gli ormoni steroidi, hanno bisogno di un maggior apporto in colesterolo. E’ proprio il caso delle ghiandole surrenali, delle ovaie e dei testicoli. Inoltre il colesterolo, come abbiamo visto, è necessario per la struttura della membrana di ogni cellula.
Il Colesterolo sd-LDL-Particle (Small Dense LDL Particle) o particella di LDL, piccola e densa. In realtà vi sono diverse sotto-classificazioni delle lipoproteine LDL. A mia conoscenza nessun laboratorio in Europa fa il dosaggio di queste particelle che come vedremo sono importanti nel valutare il rischio cardiovascolare. Negli USA diversi laboratori realizzano il dosaggio delle sd-LDL-particles nel quadro del loro “Advanced Lipid Testing”. Alla Still Osteopathic Clinics collaboriamo con laboratori esteri e abbiamo introdotto questo test nel nostro protocollo di valutazione del rischio cardiovascolare.
Il Colesterolo VLDL (Very Low Density Lipoprotein) o Lipoproteine a bassissima densità. Queste lipoproteine trasportano soprattutto trigliceridi e meno colesterolo, ed è da questo che deriva la loro bassissima densità. Il compito delle VLDL è di trasportare i trigliceridi e una minore quantità di colesterolo verso i diversi tessuti, soprattutto verso i muscoli che li useranno come carburante e verso gli adipociti del tessuto adiposo dove i trigliceridi verranno depositati come goccioline di grasso. Le VLDL contengono trigliceridi e colesterolo di origine endogeno, cioè che viene sintetizzato dal fegato. Come ho descritto nel mio articolo “Troppi Zuccheri e Carboidrati: l’alimentazione che fa ingrassare e invecchiare”, l’alimentazione ricca in zuccheri e carboidrati spinge il fegato a formare una grande quantità di trigliceridi che verranno veicolati tramite le VLDL e poi depositati nel tessuto adiposo addominale e nel fegato dove contribuiscono a formare la steatosi epatica. A differenza delle VLDL, i Chilomicroni trasportano soprattutto colesterolo e trigliceridi di origine esogena assorbita a livello dell’intestino tenue.
“In sintesi emerge dalla normale fisiologia che il Colesterolo Totale, il Colesterolo HDL e il Colesterolo LDL in sé , non costituiscono dei fattori di rischio per le malattie cardiovascolari.”
Come si sviluppa la malattia cardiovascolare ?
Le malattie croniche, dette anche NCD (Non Communicable Diseases, cioè malattie non comunicabili – non infettive) sono malattie che progrediscono lentamente prima che si manifestino nella loro forma acuta.
Una delle principali e più diffusa NCD della società moderna è la malattia cardiovascolare, che quando dalla sua forma cronica evolve verso la fase acuta, si manifesta spesso come infarto o ictus. Il cancro, la bronchite ostruttiva cronica, il diabete, l’obesità, le malattie neuro-degenerative, le malattie autoimmunitarie e la bronchite ostruttiva cronica sono le altre forme di malattie croniche dette NCD.
Le malattie croniche si manifestano in vari organi e sistemi e trovano la loro causa nei polimorfismi genetici (variazioni genetiche che si verificano in modo naturale), nello stress dovuto all’ambiente, nella dieta innaturale, nello stile di vita sregolato, nella esposizione alle tossine, nello stress psico-emozionale e nelle memorie non risolte.
“Le diverse malattie croniche come quelle cardiovascolari possono essere aggravate e mantenute da antecedenti, da fattori scatenanti e da fattori perpetuanti.”
Per le malattie cardiovascolari è stato fatto un importante sforzo sia per ridurre i fattori di rischio come il fumo, il consumo di alcol, l’eccesso di sale, la sedentarietà, sia per modificare i diversi fattori di stile di vita. Anche se questi fattori di rischio scatenano, accelerano e mantengono i disturbi cardiovascolari, non ne sono la causa profonda.
La causa profonda delle malattie croniche sono da ricercare nelle alterazioni e nei deficit di una o più vie metaboliche. Queste vie metaboliche sono fisiologiche e quando vengono disturbate, causano sintomi e segni fisici specifici.
Il problema chiave è che la medicina oggi si concentra sul debellare il sintomo della malattia cronica, spesso senza considerare i meccanismi fisiologici precoci che ne sono la causa profonda. Questo può portare ad una gestione sub-ottimale della cura delle malattie croniche. L’approccio clinico oggi più diffuso non considera la diagnosi precoce prima che i sintomi appaiano. E non è certo un semplice accertamento del livello di colesterolo nei limiti della norma che permette di escludere che non si stia sviluppando una malattia cardiovascolare.
Spesso lo sviluppo e l’evoluzione delle NCD, nel tempo, ricopre diverse decadi. Su un iniziale predisposizione genetica iniziano in un primo stadio a svilupparsi in modo molto precoce alcune disfunzioni metaboliche che dopo anni porteranno all’evento acuto e al decesso. Queste disfunzioni sono:
- l’infiammazione silente. Quando si considera l’infiammazione, si pensa spesso all’infiammazione acuta che segue un trauma o una malattia acuta come il mal di gola. Quest’ultima si riconosce con i sintomi caratteristici del dolore, rossore, gonfiore e regredisce spontaneamente dopo che è intervenuto il sistema immunitario o dopo una terapia. Ma esiste un infiammazione cronica, insidiosa, asintomatica che si protrae nel tempo e che porta al danno dei tessuti, all’invecchiamento. E’ un’infiammazione che permane a lungo, spesso non riconosciuta né ricercata, che si comporta come la goccia che cade con regolarità e scava nella roccia più dura anno dopo anno. Oggi, le più moderne tecniche di laboratorio permettono di mettere in evidenza questi indici infiammatori.
- la glicazione. E’ una reazione spontanea che lega uno zucchero semplice (glucosio, fruttosio o galattosio) con una proteina o con un lipide. Un prodotto che conosciamo bene è l’Emoglobina Glicosilata anche chiamata “Glicata” (Hb1Ac) che viene associata al Diabete. Questa reazione avviene nel sangue dove sono presenti altre sostanze che circolano liberamente e producono degli effetti finali irreversibili che si chiamano AGE’s (Advanced Glycation End Products). A livello cardiovascolare gli AGE’s provocano un irrigidimento dei vasi, inibiscono l’azione dell’ossido nitrico (NO) che permette la vasodilatazione, contribuiscono ad ossidare il colesterolo LDL e si legano ai macrofagi che in reazione producono diverse citochine pro-infiammatorie. La glicazione con il fruttosio causa venti volte più AGE’s rispetto alla stessa reazione con il glucosio. Gli AGE’s accumulati nel tempo sono in gran parte responsabili del nostro invecchiamento in quanto agiscono negativamente sulla struttura del nostro collagene.
Gli AGE’s agiscono in due modi. In un primo agiscono liberamente, senza fissarsi su specifici recettori, provocando danni a carico delle strutture delle proteine e del metabolismo della matrice extra-cellulare. In una seconda modalità, la presenza degli AGE’s provoca la formazione di recettori chiamati RAGE’s (Receptor to Advanced
Glication End Products) ai quali poi si legano.
Questi complessi AGE-RAGE innestano la produzione di citochine pro-infiammatorie come il Tnf-⍺ (Tumor Necrosis Factor-⍺ e l’IL-6 ( Interleuchina-6) che producono e sostengono nel tempo in modo sempre crescente l’infiammazione silente.
Questi complessi AGE-RAGE si auto-alimentano, cioè più AGE’s ci sono più RAGE’s si
formano, di conseguenza l’infiammazione cresce. Esistono delle tabelle che descrivono il contenuto di AGE’s, espresso in unità di kU, per tipo di alimento e modalità di cottura.
Gli AGE’s sono non soltanto prodotti all’interno del nostro organismo, ma li assumiamo
regolarmente attraverso la nostra alimentazione senza saperlo. 300 grammi di verdura cruda contengono meno di 50 AGE’s. Tre fette di speck fritte in padella, ne contengono 9.000. Il perdurare di un alto consumo di zuccheri insieme a proteine e grassi, fa sì che aumentino notevolmente l’assunzione di AGE’s. La cottura a vapore genera meno AGE’s, la cottura ad alta temperatura, la grigliata e la frittura ne generano una quantità molto elevata. L’addizione di succo di limone o la marinatura con il limone o con l’aceto impediscono la formazione di AGE’s durante la cottura.
- l’ossidazione. Tutti noi conosciamo il fenomeno di ossidazione che si manifesta spontaneamente in più forme nella nostra vita quotidiana. Cito per esempio la ruggine che si forma sul ferro quando questo entra in contatto con l’aria in presenza di umidità. Un altro esempio ė la mela appena tagliata che dopo un po di tempo sulla sua superficie passa da un colore vivo e fresco ad un colore marroncino. O ancora l’ossidazione dell’olio lasciato in una bottiglia aperta per poi constatare che l’olio è diventato rancido, cioè si è ossidato stando a contatto con l’
Il fenomeno dell’ossidazione esiste sia all’interno che all’esterno del nostro organismo. All’interno ne sono responsabili gli agenti ossidanti che fisiologicamente liberiamo durante la respirazione cellulare che ha luogo nei mitocondri delle nostre cellule. Questi agenti ossidanti anche conosciuti con il nome generico di “Radicali Liberi”, sono i ROS (Reactive Oxygen Species) e i RNS (Reactive Nigrogen Species).
I ROS sono:
- l’anione superossido (O2-): viene inattivato dall’enzima SOD (superossido dismutase). Se l’anione superossido non viene disattivato, danneggia i lipidi all’interno della membrana cellulare, le proteine, e il DNA. E’ ovvio che un tale danno se protratto nel tempo, causerà la disfunzione della normale fisiologia.
- il perossido di idrogeno (H2O2): viene disattivato dall’enzima Glutatione Perossidasi (GPX)
- il radicale ossidrilico (OH-): questo ROS, che è tra i più potenti, è prodotto dai nostri leucociti al fine di uccidere i germi patogeni. Anche questo agente ossidante viene neutralizzato dal Glutatione Perossidase. Se presenti in eccesso, i radicali ossidrilici danneggiano la membrana cellulare, le proteine e il DNA.
I RNS sono:
- il perossinitrito (ONOO-), anche esso può danneggiare la membrana cellulare, i lipidi e il nostro DNA. E’ importante sapere che il perossinitrito nasce dalla reazione fra l’anione superossido (O2-) e l’ossido nitrico (NO).
- l’ossido nitrico (NO): L’ossido Nitrico si forma a partire dall’aminoacido L-Arginina.
A differenza degli altri ROS e RNS descritti, l’ossido nitrico ha un importante ruolo protettore sull’intero organismo. E’ prodotto dai neuroni, dai muscoli, dall’endotelio vascolare e dal sistema immunitario. Una grande maggioranza di condizioni infiammatorie e autoimmuni sono caratterizzate da un’alta presenza di macrofagi e neutrofili attivati ed è così che si può produrre una significativa quantità di NO. Questo eccesso può contribuire a formare perossidonitrito arrivando a danneggiare i tessuti interessati.
L’ossido Nitrico (NO) non permette l’aggregazione piastrinica, non permette l’adesione delle piastrine e dei monociti alla parete del vaso, non permette la proliferazione della muscolatura liscia che contribuisce a formare la placca, induce la vasodilatazione e controlla la vasocostrizione impedendo così che si manifestino i primi fenomeni di ipertensione detta “essenziale”. Inoltre, inibisce la sintesi di endotelina che rappresenta la molecola con la più forte azione vasocostrittrice e infine inibisce l’ossidazione del Colesterolo LDL limitando la produzione di anticorpi Anti-LDL-Ossidati. In sintesi, quando l’endotelio è sano cioè quando non subisce il danno causato dagli agenti ossidanti, egli non permette la formazione della placca ateromasica che poi formerà il trombo. La produzione di NO viene sostenuta dall’esercizio fisico, dal digiuno breve, dai polifenoli presenti per esempio nei frutti di bosco e nel cacao, e dalla vitamina B3 ancora chiamata Niacina.
“L’ossido nitrico (NO) viene prodotto dall’endotelio vascolare e ha la funzione di proteggere tutti i vasi fino al più minuscolo capillare. La “Disfunzione Endoteliale” rappresenta la prima grande vera causa e origine delle malattie cardiovascolari.”

Fig. 5. L’ossido Nitrico (NO) inibisce l’ossidazione del Colesterolo LDL limitando così la formazione di Colesterolo LDL- Ossidato che è un elemento fondamentale per la formazione della placca ateromasica.
Abbiamo considerato finora l’ossidazione che si opera all’interno dell’organismo. E’ giusto considerare anche l’ossidazione che ha origine all’esterno del corpo e che può agire su di esso. I fattori che producono ossidazione all’esterno del corpo sono:
- il fumo di tabacco: una tirata di sigaretta libera migliaia di molecole di radicali liberi,
- il sole: i raggi UV generano agenti ossidanti che danneggiano le cellule della pelle,
- l’emissione di gas di scarico: l’inquinamento da idrocarburi crea radicali liberi nei nostri polmoni.
- i raggi X e gamma: generano radicali liberi nell’atmosfera,
- l’acqua del rubinetto: contiene metalli tossici e pesanti che generano radicali liberi.
- lo stress aumenta l’infiammazione cronica e silente,
- il ferro se prescritto in eccesso.
- le tossine in generale, che siano pesticidi, insetticidi, vernici, solventi ecc.
- i prodotti alimentari come gli alcolici, i grassi fritti.
Qual è la difesa contro gli agenti ossidanti?
Per poter neutralizzare in modo efficace i diversi agenti ossidanti, il corpo deve avere a disposizione una difesa anti-ossidante. Gli antiossidanti hanno due origini, una interna e una esterna.
Gli antiossidanti interni sono costituiti principalmente dagli enzimi SOD, GPX, Catalasi e Perossiredossine, che devono però avere a disposizione diversi co-fattori per poter agire correttamente. Sono: il ferro, il manganese, lo zinco, il rame e il nickel. Il Glutatione o Ubiquinone perché presente in modo ubiquitario, è l’agente anti-ossidante più importante del nostro corpo e deve avere a sua disposizione il Selenio per potersi rigenerare. Inoltre l’Acido Lipoico e l’Ubiquinolo anche chiamato Co-enzyma Co-Q10, hanno spiccata azione anti-ossidante. L’Acido Urico agisce elettivamente contro il perossinitrito. E’ importante precisare come ho già descritto nel mio articolo sulla melatonina, che questo ormone oltre che indurre la prima fase del sonno, ha anche azione anti-ossidante.
Gli antiossidanti esterni, introdotti nell’organismo attraverso l’alimentazione sono principalmente le vitamine A, C, e E. Il regno vegetale contiene diversi gruppi di sostanze anti-ossidanti.
Sono:
- I carotenoidi che conferiscono alla frutta e alla verdura il colore giallo, arancione e rosso. Nel gruppo dei carotenoidi troviamo il licopene (pomodori, pompelmo, anguria), la luteina (broccoli, cavolo), la zeaxantina (verdure a foglie verdi ove la clorofilla maschera il pigmento della zeaxantina (spinaci, prezzemolo).
- I bioflavonoidi: i bioflavonoidi gialli presenti nelle parti giovani dei vegetali, (broccoli, cavoli, spinaci, cornetti, insalata e nella buccia della frutta). I bioflavonoidi rossi che conferiscono ai vegetali e ai fiori il loro colore blu, rosso o viola (mirtilli, more, uva nera, barbabietola, gingko biloba). I tannini (fragole, lamponi, cruciferi). Il picnogenolo estratto dalla scorza del pino e la quercitina che impedisce l’adesione delle piastrine alla parete dei vasi, sono dei tannini.
E’ di enorme importanza per l’organismo poter neutralizzare lo stato ossidativo (danni dati dai radicali liberi) grazie ad un’altra azione anti-ossidante (anti radicali-liberi). La mancanza di controllo sugli agenti ossidativi viene chiamata “Stress Ossidativo”. I due marker dello stress ossidativo sono gli Anti-LDL-Ossidati e l’ 8OHDG. Entrambi possono essere dosati con un prelievo a digiuno. Il primo rappresenta la quota di Colesterolo LDL-Ossidato, il quale non viene identificato con il mero dosaggio del Colesterolo LDL. Il secondo marker è indice di ossidazione del nostro DNA.
“L’infiammazione silente, la produzione di AGE’s e lo Stress Ossidativo rappresentano la seconda grande vera causa e origine delle malattie cardiovascolari.”
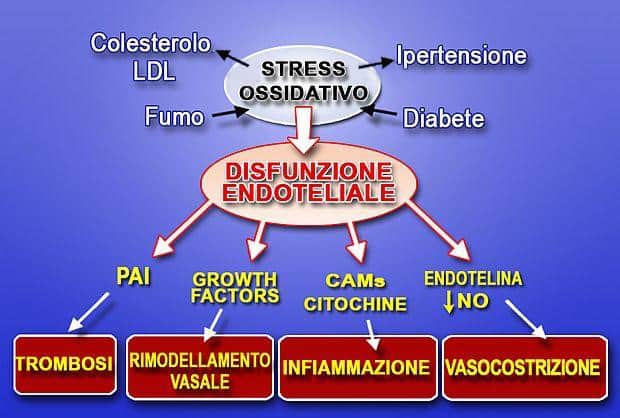
Fig. 6. Il Colesterolo LDL viene ossidato se lo Stress Ossidativo non viene controllato. Il fumo aumenta lo stress ossidativo. Il diabete aumenta il fenomeno della glicazione e la produzione degli AGE’s che a loro volta contribuiranno all’irrigidimento dei vasi, l’ipertensione aumenta il fenomeno dello stress ossidativo. Tutti questi fattori contribuiscono a creare la “Disfunzione Endoteliale” dell’endotelio del vaso. La disfunzione endoteliale diminuisce la produzione dell’ Ossido Nitrico (NO) necessario e da questo nascono in cascata: la vasocostrizione con conseguente aumento della pressione, il rimodernamento vasale, l’aumento dell’infiammazione e infine la trombosi.
Nel tempo, come progredisce il processo cronico e silente che si concluderà con la formazione del trombo e la fase acuta che porterà all’infarto ?
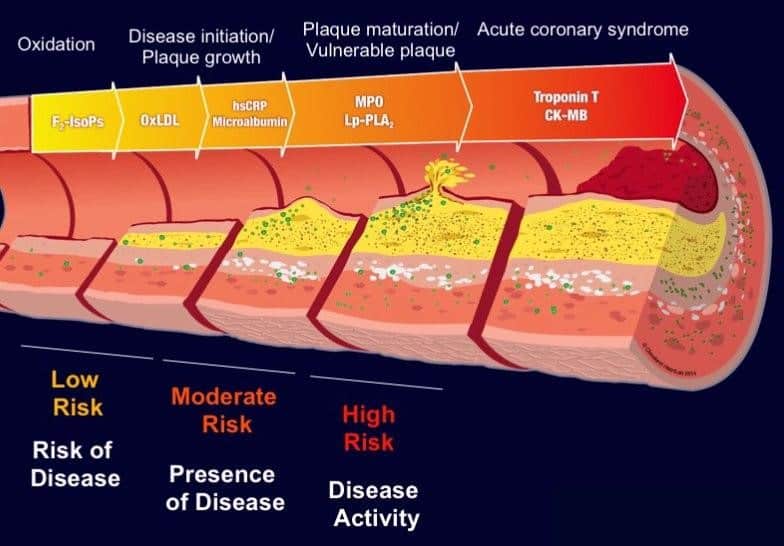
Fig. 7. L’evoluzione e la progressione del rischio e della malattia in funzione dei veri marker di rischio cardiovascolari presenti nel sangue e nell’endotelio dell’arteria.
La Prima Fase: In questa fase l’individuo è totalmente asintomatico e il rischio di malattia cardiovascolare è basso. Il rischio per un evento acuto è basso, ma il rischio di sviluppare una malattia cardiovascolare nel tempo c’è già. E’ il momento ideale per intervenire sui fattori modificabili di stile di vita, quali esercizio fisico, qualità del sonno, alimentazione, sovrappeso e abitudini tossiche come il fumo. Siamo in una fase totalmente silente.
Questa prima fase inizia sulla base di una predisposizione genetica e uno stato di stress ossidativo ove la produzione dei radicali liberi non viene più controllata dai diversi componenti della difesa anti-ossidante. In questa fase vengono formati gli F2-isoprostani (F2-IsoPs). Sono dei lipidi prostaglandine-like biologicamente attivi come mediatori dell’infiammazione. Sono dunque capaci di mediare l’inizio della malattia cronica e la sua progressione. Vengono liberati tramite l’azione dei radicali liberi sull’acido grasso, Acido Arachidonico.
A livello cardiovascolare gli F2-IsoPs agiscono come potenti vasocostrittori, che avviano la formazione di tromboxane da parte dell’endotelio vascolare e possono promuovere l’attivazione delle piastrine negli stadi più avanzati della formazione del trombo. Uno studio già condotto nel 2005 dimostra che sono un marker molto preciso e affidabile per la perossidazione dei lipidi. La loro produzione viene contrastata dagli antiossidanti Retinolo, Vit.E, Vit. C e dagli enzimi della difesa antiossidante SOD e GPX. La produzione di F2-isoprostani aumenta con il fumo di sigaretta, una dieta povera in antiossidanti e alta in AGE’s. Il test degli F2-IsoPs si effettua su un campione di urina. Il cut-off si situa a 0,86 ng/mg. Un risultato inferiore al cut-off è considerato normale.
In questa prima fase le prime molecole di Colesterolo LDL attraversano la parete del vaso e vengono ossidate diventando così, LDL-Ossidato (Ox-LDL). Queste vengono riconosciute da specifici recettori posti sui macrofagi. Questo meccanismo, che genera ulteriore infiammazione vascolare, è alla base della formazione delle Cellule Schiumose (Foam Cells). Le Ox-LDL e le Cellule Schiumose sono i primi due componenti che nel tempo formeranno la placca ateromasica. Inoltre, Le Ox-LDL inibiscono la formazione dell’ossido nitrico (NO) da parte dell’endotelio vascolare e nasce così, con l’infiammazione silente già presente, lo stato di Disfunzione Endoteliale. Le Ox-LDL possono essere dosate su un campione di sangue prelevato a digiuno. Questo test valuta il danno che ha subito la subunità proteica dell’apoproteina B (ApoB) posta sul Colesterolo LDL. Il range normale di Ox-LDL si situa tra i 60 e i 69 U/L. In un individuo assintomatico di età media, il suo innalzamento fuori range è associato a un rischio 4x maggiore per lo sviluppo di una malattia cardiovascolare coronarica. E’ un marker del rischio cardiovascolare estremamente affidabile. Il suo aumento può anche verificarsi nelle malattie renali, nella sindrome dell’ovaio policistico (PCOS) e in alcune malattie autoimmuni.
In caso di positività, è altamente consigliabile che l’individuo si sottoponga ad ulteriori test come il Profilo degli Acidi Grassi per determinare il tasso di Acido Arachidonico e l’equilibrio fra acidi grassi Omega 3 e Omega 6, e un Test dello Stato Anti-Ossidante per verificare il deficit del suo sistema antiossidante.
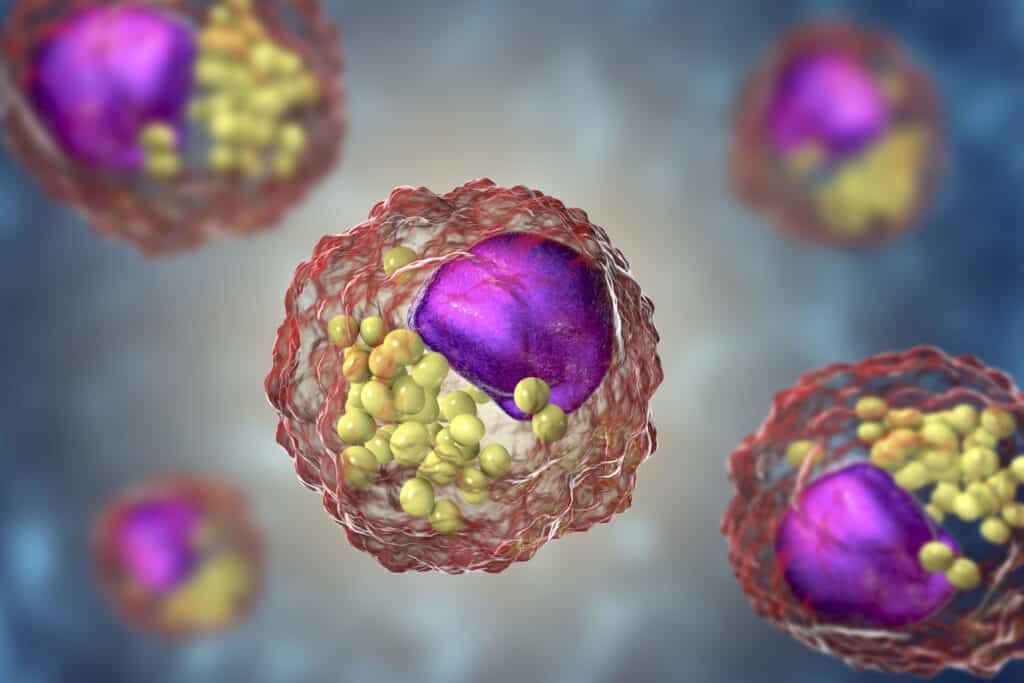
Fig. 8. La Cellula Schiumosa (Foam Cell), componente fondamentale per la formazione della placca ateromatosica. Il guscio del macrofago è costituito da fosfolipidi, in viola l’apolipoproteina ossidata, in giallo le molecole di Ox-LDL e Ox-β-VLDL entrambe ossidate.
“I due fattori di rischio in questa prima fase, F2-IsoPS e Ox-LDL, sono misurabili con un esame di laboratorio e permettono di stabilire l’inizio precoce della malattia cardiovascolare in un individuo asintomatico. I due fattori di rischio e di progressione della malattia cardiovascolare inoltre, possono essere alti anche in presenza di tassi normali del Colesterolo Totale, del Colesterolo LDL e del Colesterolo HDL.”
La Seconda Fase: In questa seconda fase il danno dell’endotelio vascolare, causato dalla continua infiammazione silente, dagli AGE’s e dallo Stress Ossidante, è presente. La malattia cardiovascolare è presente e il rischio per un evento acuto è moderato. L’ispessimento dell’intima delle arterie carotidi è già iniziato, la placca ateromasica all’interno del vaso ha già iniziato a formarsi in modo crescente, silente e asintomatico se non per un leggero aumento della pressione arteriosa spesso iniziato con un aumento della pressione minima. Siamo in uno stato di “Disfunzione Endoteliale” con una minore produzione di Ossido Nitrico (NO) e le sue inevitabili conseguenze. L’endotelio è infiammato, la regolazione della pressione per via endoteliale viene sempre meno e provoca la cosiddetta “Ipertensione Essenziale”. In medicina quando non si sa da dove viene un sintomo, lo si descrive come “essenziale”. Mi chiedo francamente come mai si continui ad ignorare la Disfunzione Endoteliale come meccanismo primario nell’apparire dell’ ipertensione che si manifesta tipicamente con un innalzamento della “Minima”, cioè della pressione diastolica.
L’endotelio vascolare tappezza l’interno di tutti i vasi e dunque anche i piccoli capillari che fanno parte del sistema di filtrazione a livello renale, cioè i glomeruli renali.
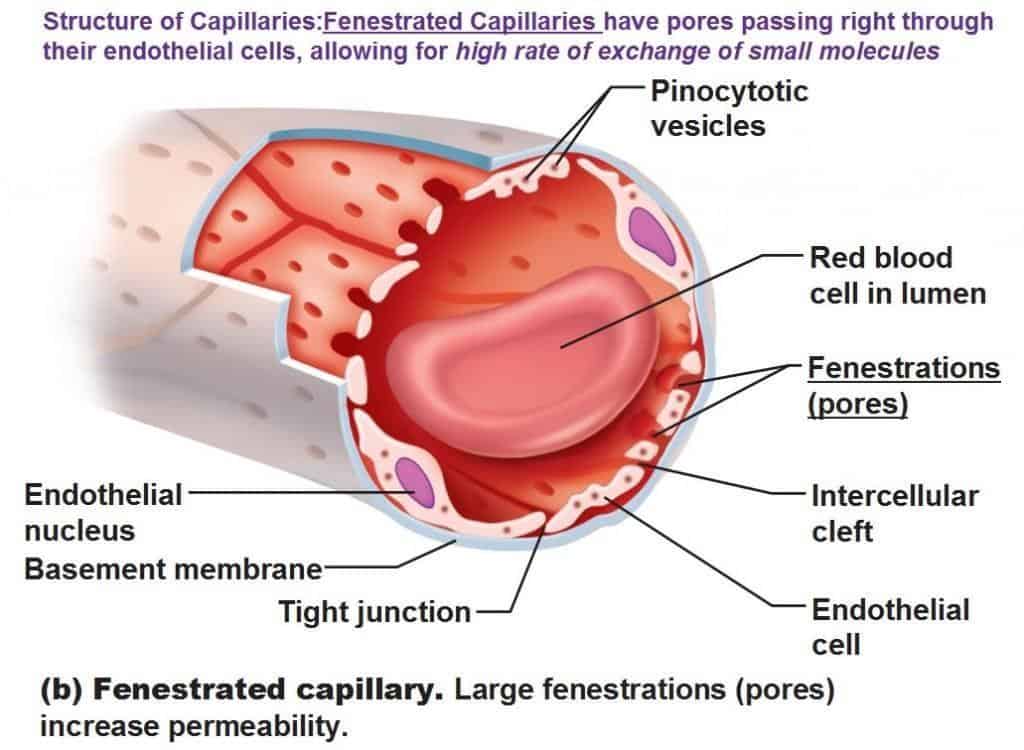
Fig. 9. Il tipo di capillare presente nel glomerulo renale è di tipo “Fenestrato”. Permette il passaggio di diverse molecole dal lume del vaso verso il tubuli renali che poi porteranno via le molecole da eliminare, via l’urina, verso l’esterno dell’organismo.
L’endotelio vascolare possiede delle strutture chiamate “Giunzione Serrata” (Tight Junctions” che fanno sì che lo spazio tra una cellula e l’altra non sia permeabile. Ho già descritto l’analoga struttura nel mio articolo sui “Disturbi Correlati al Consumo del Glutine”. Infatti la stessa struttura a Giunzione Serrata presente a livello della mucosa intestinale, la troviamo anche nell’endotelio vascolare.
Quando queste giunzioni serrate vengono danneggiate dall’infiammazione, dagli AGE’s e dallo Stress Ossidativo, il capillare renale diventa più permeabile fino a diventarlo troppo. Così l’aumentata permeabilità che si verifica a livello intestinale con gli stessi meccanismi, la ritroviamo anche qui a livello della filtrazione renale. In questo modo la filtrazione renale diventa meno selettiva e alcune molecole che non devono normalmente entrare nel filtrato renale iniziano a ritrovarsi nell’urina. E’ il caso dell’albumina, ove sue piccole quantità passano la barriera di filtrazione e si riversano nell’urina. Questo stato iniziale di perdita di filtrazione selettiva causa la “Micro-albuminuria”, cioè la presenza di minute quantità di albumina nelle urine. Essa costituisce un marker per la “Disfunzione Endoteliale” e può essere dosata nell’ urina delle 24 ore. Per definizione, si parla di Micro-albuminuria per concentrazioni di albumina comprese 30 e 300 mg nelle urine delle 24 ore.
In un articolo pubblicato nel Journal of the American Medical Association (JAMA) nel 2001, viene descritto il “Hope Study” che ha stabilito che più è alta la microalbuminuria negli individui diabetici e non-diabetici, più è alto il rischio cardiovascolare.
Oltre alla micro-albuminuria, in questa seconda fase appare un altro indicatore di rischio cardiovascolare. Man mano che l’infiammazione silente aumenta tramite la produzione di Tnf-⍺, IL-1 e IL-6, il fegato produce una proteina di nome “Proteina C Reattiva” (PCR). La produzione di questa proteina di fase acuta è totalmente indipendente dai livelli di trigliceridi e colesterolo totale, HDL e LDL. L’esame della PCR sul sangue permette di rilevare concentrazioni dai 3 mg/L in sù. Oggi, con le nuove tecniche di laboratorio si può richiedere un dosaggio di PCR ultra-sensibile (PCR-us) che permette di rilevare quantità minori da 1mg/L in su. La stato della PCR-us elevato determina:
- l’aumento dell’ossidazione del Colesterolo LDL, e quindi la formazione di Ox-LDL,
- l’aumento della produzione di Endotelina-1 da parte dell’endotelio, e quindi un aumento della pressione vascolare che può sfociare in ipertensione conclamata,
- la diminuzione della produzione di Ossido Nitrico (NO) ad azione vasodilatatoria,
- l’aumento dell’espressione delle molecole d’adesione cellulari al vaso (Cell Adhesion Molecules – CAM),
- l’aumento delle infiltrazioni di globuli bianchi, monociti, attraverso la parete vascolare,
- l’aumento della formazione di Tromboplastina Tissutale, (Fattore III), presente nel tessuto sub-endoteliale, necessaria per produrre la trombina che porta alla coagulazione del sangue e dunque facilita la formazione del trombo che darà il via alla fase cardiovascolare acuta,
- la diminuzione della fibrolisi, tramite l’aumento di espressione dell’inibitore dell’ Attivatore del Plasminogeno-1 (Plaminogen Activator Inhibitor-1 o PAI-1)
L’aumento della PCR-us non è specifica delle malattie cardiovascolari ma rappresenta un sicuro fattore di rischio in quanto accelera, come appena elencato, tutti i processi metabolici che portano agli eventi cardiovascolari acuti. L’aumento della PCR si riscontra anche nell’insorgere di stati infiammatori legati a traumi, infezioni, malattie autoimmuni, tumori, epatiti ecc.
Il tasso della PCR determina anche la probabilità di sopravvivenza dopo un infarto. La Women’s Health Study (WHS) condotto su 28.345 donne, ha stabilito che la sopravvivenza dopo un infarto diminuiva considerevolmente se la paziente aveva una PCR elevata.
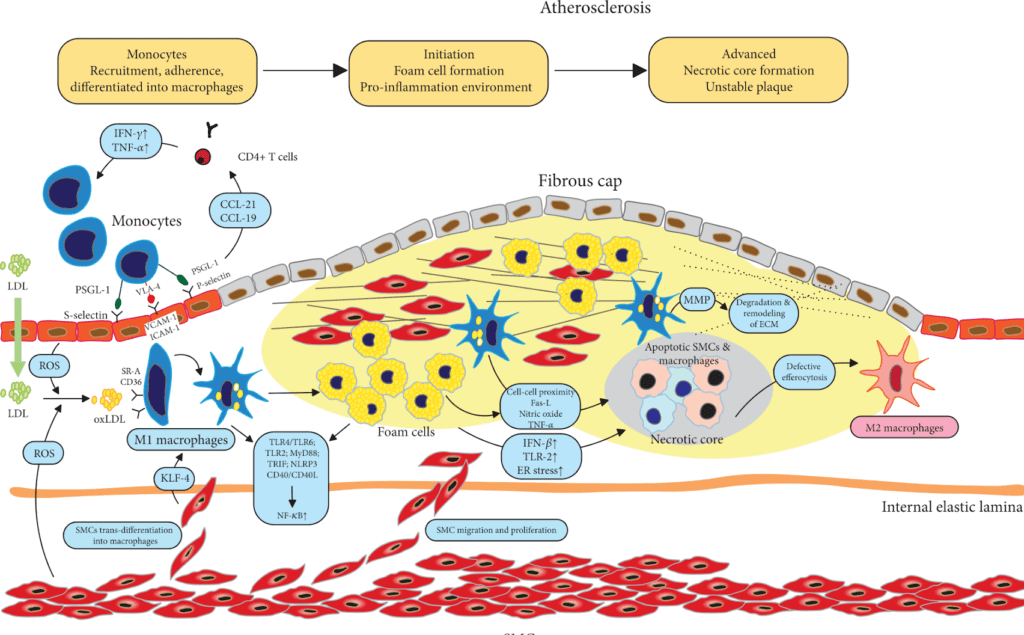
Fig. 10. Formazione della placca ateromasica all’interno dell’arteria. Da sinistra a destra: Il colesterolo LDL (in verde) penetra attraverso l’endotelio danneggiato e viene ossidato dai ROS (in celeste) per produrre il Ox-LDL (in giallo). I macrofagi (in blu) assorbono l’Ox-LDL e contribuiscono a formare le Cellule Schiumose (in giallo con il centro nero). All’esterno dell’arteria (parte superiore dell’immagine) i globuli bianchi monociti rispondono all’aumento del Tnf-⍺ pro-infiammatorio e migrano attraverso l’endotelio per contribuire alla formazione delle Cellule Schiumose. Dallo strato muscolare dell’arteria (parte inferiore dell’immagine) alcune fibre muscolari (in rosso) proliferano e migrano verso il sito della placca attraversando la lamina elastica interna del vaso (in arancione) per poi raggiungere gli altri componenti della placca. Al centro della placca, con l’aumentare dello stato infiammatorio, si forma un Nucleo Necrotico (in grigio) formato da cellule morte e macrofagi. In questa fase, la placca viene ancora contenuta dalla sua capsula fibrotica (cellule in grigio con nucleo marrone). La placca ateromasica inizia già a calcificarsi e a occludere il lume dell’arteria.
“Il danno dell’endotelio che risulta in micro-albuminuria e l’aumento dell’infiammazione che porta all’innalzamento della PCR-us, rappresentano la terza grande vera causa e origine delle malattie cardiovascolari. Inoltre, in questo contesto, la micro-albuminuria e la PCR-us sono dei marker della progressione del rischio malattia cardiovascolare.”
La Terza Fase. Oramai la placca ateromasica è presente e matura. La malattia è presente e il rischio è alto. Inizia la fase della placca ateromasica vulnerabile, cioè instabile dalla quale si staccherà il trombo. In questa fase due fattori contribuiscono alla formazione e al distacco del trombo.
La capsula fibrotica che ricopre la placca inizia a fessurarsi sotto l’azione crescente dell’ossidazione. In particolare, i leucociti producono un enzima chiamato “Mieloperossidasi” (MPO) che genera alte quantità di ROS al fine di distruggere particelle che riconoscono come estranee. Questa Mieloperossidasi può essere dosata nel sangue e in questa fase, insieme con gli altri marker descritti, costituisce un marker per il rischio cardiovascolare e per la progressione della malattia. Il valore normale della MPO si situa a meno di 400 pmol/L. Il rischio è alto se superiore a 480pmol/L. Nelle vasculiti e nei danni glomerulari, si formano degli anticorpi anti-MPO che normalmente non devono superare i 6 U/mL.
Il secondo fattore che in questa fase rappresenta una fattore determinante di alto rischio e che deve far pensare ad un probabile evento acuto imminente, è l’innalzamento dell’enzima LpPLA2 o Lipoprotein-associated Phopholipase A2 anche nota come Platelet-activating Factor Acetylhydrolase (PAF-AH). La LpPLA2 entra nella placca con il trasporto delle Ox-LDL. Inoltre viene prodotta all’interno della placca stessa dai macrofagi, mastociti e linfociti T. L’azione della LpPLA2 è di liquefare la placca dal suo interno, rendendola così instabile e contribuendo con il concorso della MPO alla rottura della capsula fibrosa e al distacco del trombo.
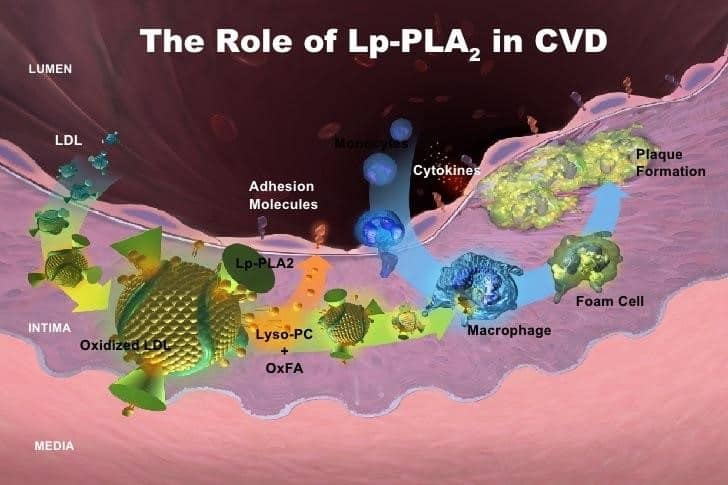
Fig. 11. Da sinistra a destra: LDL entra nell’ intima del vaso attraversando l’endotelio danneggiato. Le Ox-LDL con il concorso dei macrofagi attivati dall’infiammazione sempre crescente, formano le Cellule Schiumose. La Lp-PLA2 liquefa la placca, rende la placca instabile e insieme all’innalzarsi della MPO, provoca il distacco del trombo.
Il valore normale del Lp-PLA2 nel sangue è di meno di 200 µg/L. Il test Lp-PLA2 viene anche chiamato “PLAC TEST”. Nuovi studi genetici dimostrano che una carenza dell’attività della Lp-PLA2 protegge dalle malattie cardiovascolari. La perdita di funzione di una parte del gene Lp-PLA2 (V279F), è associato ad una significativa riduzione degli eventi cardiovascolari. Questi risultati confermano l’esistenza di una relazione di causa-effetto tra Lp-PLA2 e la malattia coronarica (Coronary Artery Disease – CAD).
“I due fattori di rischio in questa terza fase, MPO e LpPLA2, possono essere valutati tramite un esame del sangue e indicano in modo ben obbiettivato e affidabile l’imminente rischio per un evento cardiovascolare acuto. Come per gli indicatori di rischio delle fasi precedenti, la MPO e la LpPLA2 possono essere alti anche in presenza di tassi normali del Colesterolo Totale, del Colesterolo LDL e del Colesterolo HDL.”
In presenza di un alto tasso della Lp-PLA2 è necessario ricorrere ad un esame strumentale che permette di obiettivare il grado di ostruzione dei vasi coronarici. A tale scopo possono essere eseguiti vari esami. La coronarografia è invasiva in quanto viene eseguita per mezzo del cateterismo cardiaco. La rivoluzione dell’esame per chi è a rischio di un evento cardiovascolare è la CARDIO TC- CAC SCORE (Coronary Artery Calcium Score). Si tratta di un esame TAC senza contrasto che consente di misurare il contenuto di calcio coronarico sulla parete del vaso arterioso differenziandolo dal calcio circolante in quanto ha maggior densità. Non occorre preparazione particolare e non bisogna essere a digiuno. L’esame stesso dura 10 secondi e permette la diagnosi precoce di coronopatia al fine di prevenire eventi infausti.
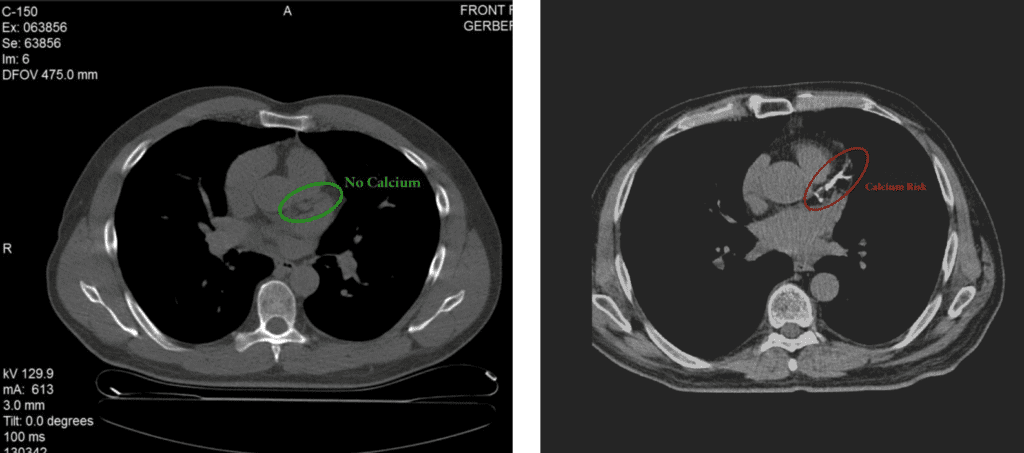
Fig. 12. Cardio Tac – CAC Score. (Coronary Artery Calcium Score). A sinistra un’ immagine nella quale l’arteria coronaria sinistra risulta pervia e senza calcificazioni. A destra, l’arteria coronaria sinistra risulta ostruita e con calcificazioni. L’esame non ė invasivo, è veloce, non è doloroso e permette di stabilire la diagnosi di alto rischio per un evento cardiovascolare acuto in un soggetto asintomatico e con livelli di colesterolo che risultano essere nella norma.
La Quarta Fase. E’ la fase dell’evento cardiovascolare acuto, dell’infarto improvviso o dell’ictus. Non si parla più di fattore di rischio cardiovascolare ma di rischio di perdere la vita per un evento cardiovascolare che avrebbe meritato un miglior e più completo approccio preventivo-diagnostico che il mero livello di Colesterolo Totale, HDL e LDL.
I livelli del Colesterolo Totale, HDL e LDL nella norma sono indice di assenza di rischio per un evento cardiovascolare?
No, assolutamente no. Tutti i fattori di rischio cardiovascolari descritti possono essere alterati senza che i tassi del colesterolo lo siano. Anzi, uno studio pubblicato nel 2019 e realizzato su 347.000 soggetti, dimostra che bassi livelli di Colesterolo LDL sono indipendentemente e in modo importante associati con un aumento di rischio per mortalità di tutte le malattie, incluse quelle cardiovascolari (Ki Chul Sung et al., Low Levels of LDL Cholesterol and Mortality Outcomes in Non-Statin Users – in Journal of Clinical Medicine – 2019). Un altro studio pubblicato nel British Medical Journal nel 2016, conclude che una riduzione del colesterolo non porta ad una diminuzione del rischio di mortalità per tutte le malattie, ma un 13,8 % di riduzione di colesterolo per via alimentare aumenta la mortalità del 20 % (Ramsen CE et al., Re-evaluation of the traditional diet-heart hypothesis: analysis of recovered data from the Minnesota Coronary Experiment – 1968-73, British Medica Journal, 2016).
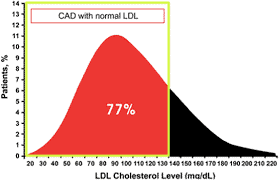
Fig. 13. CAD (Coronary Artery Disease) with Normal LDL. In 77 % dei casi di Malattia delle arterie coronariche, i livelli di Colesterolo LDL è risultato nella norma.
E le statine ? Effetti collaterali noti e meno noti
La statina è un medicinale che inibisce la sintesi del colesterolo endogeno, tramite l’inibizione dell’enzima HMG-CoA-Reduttasi. Alcune persone, conoscendo gli effetti collaterali delle statine, preferiscono assumere un inibitore della sintesi del colesterolo naturale. Si tratta del riso rosso fermentato. Ebbene, il riso rosso fermentato, contenente Monacolina K, ha la stessa azione delle le statine, né più né meno perché inibisce lo stesso enzima di sintesi, cioè l’HMG-CoA-Reduttasi.
Abbiamo visto i ruoli fisiologici del colesterolo come precursore della vitamina D, precursore di tutti gli ormoni steroidi, costituente della membrana cellulare, della formazione della bile, della formazione delle guaine di mielina dei nervi, della partecipazione alla divisione cellulare e allo sviluppo armonioso del feto durante la gravidanza. Diminuire il colestorolo equivale a squilibrare questi ruoli fisiologici. Infatti, le statine sono controindicate in caso di gravidanza.
Gli effetti collaterali ben noti delle statine sono:
- disturbi digestivi come dispepsia, flatulenza, stitichezza, diarrea, nausea, vomito, colite
- disturbi e dolori articolari e muscolari, crampi muscolari, perdita di massa muscolare
- disturbi neurologici come mal di testa, alterazione della sensibilità dei nervi, insonnia
- disturbi respiratori
- disturbi della pelle ed eruzioni cutanee
- disturbi renali e innalzamento dei livelli degli enzimi epatici
Gli effetti collaterali meno noti delle statine sono:
- diminuzione del 12 % della produzione di insulina da parte del pancreas parallelamente ad una riduzione della sensibilità all’insulina del 24 %. Numerosi studi pubblicati come nel Britisch Medical Journal (2013) e nel giornale Diabetologia (2015), dimostrano che la Simvastatina induce il diabete in 44 % dei soggetti sani e l’Atorvastatina induce il diabete in 37% dei soggetti sani.
- inibizione del Co-enzima Co-Q10. Questo enzima ha un’importante azione antiossidante e fa parte integrante della catena respiratoria cellulare che produce la nostra energia. Infatti, il Co-enzima Co-Q10 è un componente importantissimo per la fisiologia dei citocromi responsabile del buon funzionamento del mitocondrio. Le statine provocano un danno del mitocondrio che poi si traduce in astenia, dolori muscolari e ed articolari, oltre che ad un invecchiamento e un rallentamento psico-fisico precoce.
- inibizione della sintesi della Vitamina K2, la quale è sinergica con la Vitamina D.
- inibizione della sintesi dell’enzima Gluatione Perossidase (GPX), che come abbiamo visto è un importante enzima antiossidante.
- emorragie cerebrali. Uno studio pubblicato nel 2019 nel giornale medico “Neurology”
(LDL Colesterol and Risk of Intracerebrale Hemorrhage) mette in evidenza che il rischio di emorragia cerebrale sale in maniera importante se il livello del Colesterolo LDL
scende sotto i 75 mg/dL.
Da quanto spiegato sopra, abbiamo un farmaco che viene prescritto per il “rischio cardiovascolare” che rappresenta il Colesterolo non-ossidato, che aumenta il vero rischio cardiovascolare.
“Diventa chiaro che il trattamento con le statine, aumenta lo stress ossidante e induce un diabete favorendo l’inibizione dell’insulina.” Non sarebbe meglio agire sui meccanismi dell’infiammazione silente, sul potenziamento della difesa anti-ossidante, sulla riduzione degli AGE’s e sui fattori di stile di vita ?”
E i nuovi farmaci come il PCSK9 inibitore?
La proteina “PCSK9” neutralizza i recettori del colesterolo che sono posti sull’esterno delle membrane cellulari del fegato. Il nuovo farmaco, Evolocumab, si lega al PCSK9 e impedisce così la neutralizzazione dei recettori all’interno delle cellule e quindi aumenta il numero di recettori presenti sulla superficie cellulare, dove possono legarsi al colesterolo LDL e rimuoverlo dal flusso sanguigno. Ciò contribuisce a ridurre il livello sanguigno del colesterolo, ma non riduce il colesterolo fissato sulla membrana cellulare. Alla fine, il colesterolo viene cosi ridistribuito ma non viene diminuito.
Da quanto sopra, dunque questo farmaco non riduce il Colesterolo LDL ma lo sposta dal flusso ematico sulla superficie delle cellule dove può essere ossidato, glicato e aggredito insieme agli altri componenti della membrana cellulare secondo il grado di infiammazione silente presente.
L’ Evolucumab viene somministrato agli adulti e ai bambini di età dai 12 anni in su, prevede una iniezione sotto-pelle due o una volta al mese con una dose che varia dai 140 mg ai 420 mg a seconda della frequenza di somministrazione. Se dopo due settimane non si ottiene la risposta desiderata, cioè l’abbassamento del livello di colesterolo, la dose di 420 mg può essere somministrata due volte a settimana. Inoltre, per i soggetti di più di 65 anni che già hanno una minore produzione dei diversi ormoni steroidi, delle membrane cellulari già “invecchiate” e un stress ossidante importante, gli aggiustamenti delle dosi da somministrare vengono dichiarate come non necessarie. Gli effetti collaterali dell’Evolocumab sono simili a quelli del gruppo delle statine.
Uno studio pubblicato nel 2020, (Van Bruggen F.H., Nijhuis G.B.J., Zuidema S.U., Luijendijk H. Serious Events and Deaths in PCSK9 Inhibitor Trial Reported on ClinicalTrials.gov: A systematic Review, Expert Review of Clinical Pharmacology, Vol. 13, 2020, Issue 7.) conclude:
“La nostra meta-analisi degli eventi clinici registrati su Clinical Trials.gov, non hanno dimostrato che l’inibitore del PCSK9 abbia migliorato la salute cardiovascolare. I‘ Evolocumab ha invece aumentato il rischio di mortalità in tutte le cause di morte per malattia.”
Quali sono dunque i livelli “normali desiderabili” dei diversi Colesteroli ?
Nel momento in cui scrivo questo articolo, i livelli di riferimento sono:
- Colesterolo Totale: meno di 200 mg/dL
- Colesterolo LDL: meno di 100 mg/dL
- Colesterolo HDL: più di 40 mg/dL
Perché dico nel momento in cui scrivo questo articolo ? Perché ogni tot di anni le linee guida diminuiscono i livelli di colesterolo “desiderabile”. Qualche anno fa il livello normale del colesterolo totale era pari a 240 mg/dL, poi è stato diminuito a 220 mg/dL e ora lo troviamo ridotto a 200 mg/dL. Esiste già una tendenza a volerlo ridurre ulteriormente a 180 mg/dL in quanto questo tasso viene considerato “ideale”. Ma, chiedo, così non si creano nuovi “malati” ogni anno?
Conclusione
Le malattie cardiovascolari nascono da una predisposizione genetica ed evolvono secondo il grado di infiammazione silente, ossidazione e glicazione presente. Tali processi metabolici possono essere aumentati e accelerati dai fattori di stile di vita. I principali fattori di stile di vita modificabili sono: il movimento e la sendentarietà, l’alimentazione e l’idratazione, la qualità del sonno e la pace mentale, il sovrappeso e l’obesità e la gestione dello stress.
I livelli di Colesterolo Totale, LDL e HDL, ora ancora esageratamente considerati come fattori di rischio principale per le malattie cardiovascolari e che continuano a giustificare la prescrizione di statine e di PCSK9-inibitori, non sono i veri fattori di rischio. Lo dimostrano le morti per infarto ove il livelli di colesterolo sono nella norma. Non solo, ma i livelli troppo bassi di Colesterolo LDL sono correlati con un aumento delle morti per tutte le cause di malattia.
I veri fattori di rischio che possono essere facilmente valutati con un analisi del sangue e delle urine sono: F2IsoPs, Ox-LDL, PCR-us, Micro-albuminuria, MPO e Lp-PLA2.
Anche le difese anti-ossidanti possono essere valutate mediante una analisi del sangue e delle urine: Vit A, Vit. C, Vit. E, Co-enzima Co-Q10, SOD, GPX, Selenio, Mn, Cu, e Zn. Inoltre si possono valutare i danni causati dallo Stress Ossidanti esaminando, sempre mediante analisi del sangue e delle urine, i valori dei marker dell’ossidazione: Ox-LDL e 8OHDG.
Nuovi marker del rischio atero-genetico stanno tuttora emergendo. Gli studi del Dr. Massimo Cocchi rivalutano, in positivo, il ruolo dell’Acido Stearico (AS), identificando nelle Piastrine un tessuto di particolare interesse relativamente alla composizione in acidi grassi, nel loro ruolo critico del controllo del processo emocoagulativo e, quindi, dell’eventuale rischio trombo-genetico. Appare anche che l’Acido Linoleico presente nelle piastrine, sia inversamente correlato come fattore di rischio nelle malattie cardiovascolari. Inoltre si profilano diversi fattori di rischio correlati con il microbiota intestinale. Infatti la presenza del TMAO, (Trimetilammina-N-Ossido) che possiamo valutare con un esame del sangue, è correlato con una disbiosi intestinale e che la presenza di batteri patogeni nella popolazione del microbiota intestinale, costituisce un fattore di rischio cardio-vascolare.
Bill Clinton passò con successo per diversi anni vari check-up annuali ma fu vittima di un infarto 9 anni dopo il termine della sua presidenza degli Stati Uniti. Già nel 2004 fu operato per bypass quadruplo dopo che un angiografia rivelò diverse ostruzioni vascolari. La fortuna vuole che in quel pomeriggio dell’11 Febbraio del 2010, fu portato subito in sala operatoria per inserire due stent nelle sue arterie coronarie. Durante i suoi check-up gli furono fatti degli esami per valutare il suo colesterolo ma non gli furono fatti i test per valutare i veri marker di rischio cardiovascolare. Oggi, la maggioranza degli americani dai 40 anni in su, per motivi di prevenzione e valutazione del rischio cardiovascolare, oltre a sottoporsi ai test ematici e urinari per la valutazione dei veri marker cardio-vascolari, si sottopongono anche alla CardioTac con Cac-Score.
Andrew Boardman, maratoneta britannico di 46 anni in apparente splendente forma fisica non fu fortunato come l’ex Presidente Clinton. Negli anni precedenti l’atleta aveva già corso sei maratone. Quel Sabato 3 Agosto del 2016, mentre si apprestava ad iniziare la sua settima maratona, si avvicinò alla linea di partenza tracciata sulla Tower Road a Blackburne e improvvisamente crollò per terra e morì vittima di un infarto.
Tutte le malattie croniche (Non Communicable Diseases, NCD), hanno come denominatore comune di insediarsi in modo silente e progressivo prima che l’evento acuto si manifesti. E’ assolutamente necessario che si possa ricorrere ad analisi di laboratorio e ad esami strumentali che possano mettere in luce le manifestazioni precoci al fine di prevenire i fenomeni acuti della malattia. Spesso le procedure adottate non coprono gli stadi precoci della malattia. Una procedura più completa come quella adottata alla Still Osteopathic Clinics con il Test Cardio-Metabolico che valuta nel sangue e nelle urine i veri rischi cardio-metabolici, copre questa mancanza.
È questa l’occasione per smitizzare la favola del consumo delle uova che fa aumentare il colesterolo. Uno studio già pubblicato nel 1979 dall’American Journal of Clinical Nutrition (M.A. Flynn, Effect of Dietary Egg on Human Serum Cholesterol and Triglycerides) analizza il colesterolo e i trigliceridi di 116 uomini con età tra i 32 e i 62 anni che hanno mangiato giornalmente 3 uova durante un periodo di 3 mesi.
La conclusione è che in tutta la popolazione non è stato osservato nessun aumento di colesterolo, né di trigliceridi. Un altro studio pubblicato nel 2000, non solo dimostra che non vi è un aumento di colesterolo ematico quando si mangiano le uova in modo giornaliero, ma più se ne mangiano meno è il livello del colesterolo.
Inoltre, contemporaneamente aumentano i livelli ematici di diversi nutrienti importanti per il nostro organismo. Sono le vitamine B6, B12, C ed È. (Song W. Nutritional Contribution of Eggs to American Diets, Journal of the American College of Nutrition, June 1, 2000
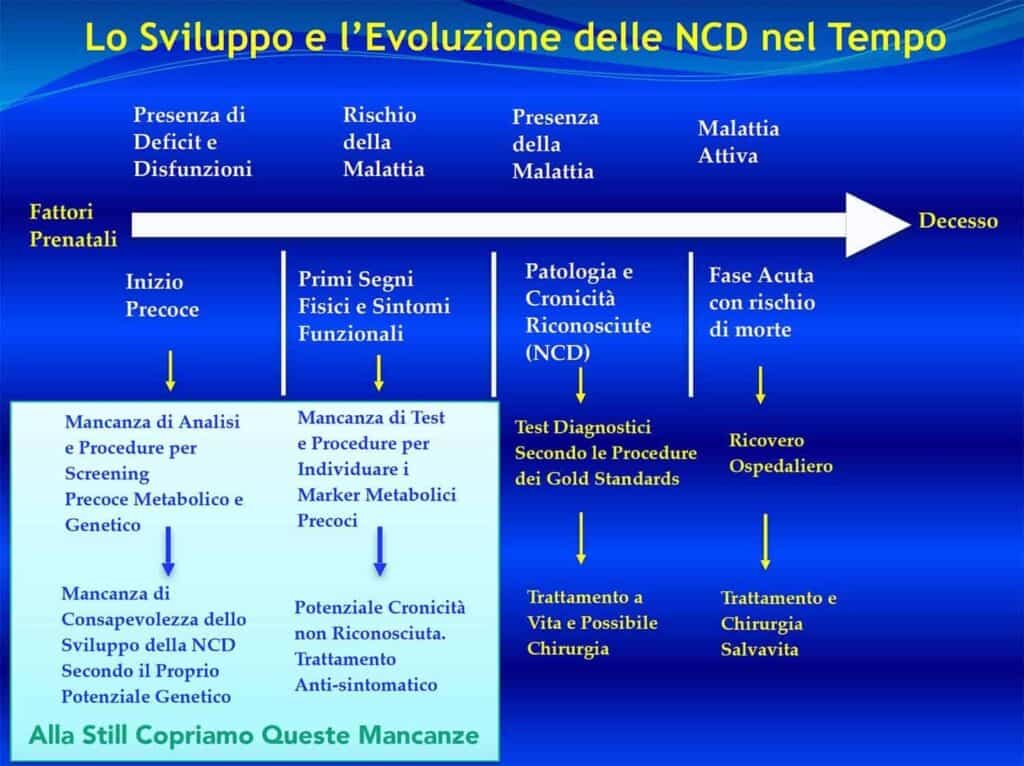
Fig 14: Le malattie cardio-vascolari, come tutte le NCD, si sviluppano nel tempo in modo silente e insidioso. E’ di enorme importanza valutare in modo precoce la presenza dei veri marker di rischio al fine di poter evitare il sorgere di infarti e ictus improvvisi.
In ultima conclusione, il colesterolo è innocente e chiedo che venga assolto in quanto è ora dimostrato che non è il vero colpevole. Invece, chiedo che vengano condannati con attenuanti, i meccanismi dell’infiammazione, dell’ossidazione e della glicazione. Con attenuante perché spesso è l’individuo stesso che nella sua inconsapevolezza è complice nel mantenere in essere fattori di stile di vita che non sono in armonia con il suo Cuore.
Bibliografia
Aiman U., Najmai A., Khan RA., Statin Induced Diabetes and its Clinica Implications Journal of Pharmacology & Pharmactherapeutics, July-Sept 2014; 5 (3): 181-185
Bandish K., Parimal M., Uday S, Vasundhara K. Simvastatin may induce insulin resistance through a novel fatty acid mediated cholesterol independent mechanism
Scientific Reports, 5 Article number: 13823 (2015)
Bell DSH., DiNicolantonio J.J., O’Keefe J.H. Is Statin-induced diabetes clinically relevant ? A comprehensive review of the literature Diabetes, Obesity and Metabolism, 24 Dec 2014
Berg K., Lp(a) lipoprotein: an overview Chem Phys Lipids 1994 Jan;67-68:9-16. doi: 10.1016/0009-3084(94)90119-8.
Blaha MJ, Cainzos-Achirica M, Greenland P, McEvoy JW, Blankstein R, Budoff MJ, et al. Role of coronary artery calcium score of zero and other negative risk markers for cardiovascular disease: the Multi-Ethnic Study of Atherosclerosis. Circulation. 2016;133(9)
Budoff MJ, Shaw LJ, Liu ST, Weinstein SR, Mosler TP, Tseng PH, et al. Long-term prognosis associated with coronary calcification: observations from a registry of 25,253 patients. J Am Coll Cardiol. 2007;49(18):1860–70.
Burgstahler C, Cipowicz H, Thomas C, Schabel C, Mangold S, Ketelsen D, et al. Coronary and carotid atherosclerosis in asymptomatic male marathon runners. Scand J Med Sci Sports. 2017. Epub 2017/12/15. doi:10.1111/sms.13035. PubMed PMID: 29239051.
Butler A.E., Paseban M., Sahebkar A. Mechanism of Statin-induced New-onset Diabetes Journal of Cellular Physiology, 7 Jan 2019
Chaudhuri J., The role of glycation products in aging and metabolic diseases: bridging association and causality. Cell Metabolism. Sep. 4th, 2018. 28(39: 337-352
Cocchi M.,Toniello L., Capello G., Bosi S.,A. Cremonesi, Castriota F., Mercante M., Tarozzi G., Bochicchio D., Della Casa G., Caramia G. Acidi grassi delle piastrine: un modello di tipizzazione biochimica della cardiopatia vascolare ischemica nell’interpretazione di una Rete Neurale Artificiale. Progess in Nutrition, Vol. 10, N°1, 58-64, 2008
Cocchi M.,Toniello L., Gli Acidi Grassi delle Piastrine: un possibile modello di classificazione animale ? Progess in Nutrition, Vol. 10, N°1, 58-64, 2008
Donaldson James S., Childs D. Bill Clinton Hospitalized for Routine Stent Surgery; Stress may have triggered chest pain ABC News Feb. 11, 2010, New York.
Ganda Om P. Statin-induced diabetes: incidence, mechanisms, and implications F1000Research, 2016 – nubi.nlm.nih.gov Gernstein H.C., et al. Albuminuria and risk for cardiovascular events, death and heart failure in diabetic and non-diabetic individuals JAMA, 127, 2001
Greenland P, Blaha MJ, Budoff MJ, Erbel R, Watson KE. Coronary calcium score and cardiovascular risk. Am. Coll. Cardiol. 2018;72(4)
Henriksbo B.D., Shertzer J.D. Is Immunity a mechanism contributing to statin-induced diabetes ? Adipocyte, vol. 4, Issue 4, 2015
Wikipedia.org – La Zattera Lipidica
Ivanova A. E., Myasoedova V. A., Melnichenko A. A., Grechko A. V., Orekhov A. N., Small Dense Low-Density Lipoprotein as Biomarker for Atherosclerotic Diseases Oxid Med Cell Longev. May 7th 2017; 2017: 1273042 Ki Chul Sung et al. Low levels of LDL Cholesterol and Mortality Outcomes in Non-statin Users Journal of Clinical Medicine, October 1st 2019
Laukova L., Weiss R., Semak V., Desialylation of platelet surface glycans enhances platelet adhesion to adsorbent polymers for lipoprotein apheresis. International Journal of Artificial Organs, Nov. 3rd, 2020.
Mezentsev A., Bezsonov E., Kashirskikh D., Baig M.S., Proatherogenic Sialidases and Desialylated Lipoproteins: 35 year Research and Current State from Bench to Bedside Biomedicines 9(6), 600, May 25th 2021,
Milne G.L., Musei E.S., Morrow J.D., F2-isoprostanes as markers of oxidative stress in vivo: an overview Biomarkers. 2005 Nov; 10 Suppl 1:1:S10-23
Mitchell P., Marette A. Statin-Induced Insulin Resistance through Inflammasome Activation Diabetes 2014 Nov; 63(11): 3569-3571
Morteza M., David D., Kloner A., Berman S., Budoff M., Superko H., Shah P. Coronary Artery Calcium Testing: A Call for Universal Coverage Preventive Medicine Reports, Vol. 24, in progress – December 2021
Ranskov U et Al. Lack of an association or an inverse association between LDL Colesterol ad mortality in the elderly: a systematic review. British Medical Journal, Open 12;6(6):e01040, 2016. Doi: 10.1136/bmjo-pwn2015-01040
Sandoiu A. Very low levels of “bad” cholesterol may raise stroke risk Medical News Today, July 4th 2019
Sharma, S.B., Small Dense LDL: Risk Factor for Coronary Artery Disease (CAD) and its Therapeutic Modulation. Niscair Online Periodicals Repositary, India, Apr. 2012
Speciani Luca, Cinquant’anni di Piccole Bugie, in L’altra Medicina, n° 94, Apr. 2020. Ed. Editoriale C&C Srl, Milano, Italia
Stroud C. Marathon Man Tragedy. Super-fit runner collapsed and died from a massive stroke as he walked to the start line of a race. The Sun, Aug. 3, 2016
Teng N., Maghzal G.J., Talib J., Rashid I. The roles of myeloperoxidase in coronary artery disease and its potential implication in plaque rupture. Redox Report. Communications in Free Radical Research, Vol. 22, 2017 – Issue 2
Van Bruggen F.H., Nijhuis G.B.J., Zuidema S.U., Luijendijk H. Serious Events and Deaths in PCSK9 Inhibitor Trial Reported on ClinicalTrials.gov: A systematic Review Expert Review of Clinical Pharmacology, Vol. 13, 2020, Issue 7.



